마지막 안전성 테스트 통과만 남겨
2018년 시판 땐 연 1조 매출 기대 SK그룹이 5대 성장 사업 중 하나로 꼽은 바이오·제약 부문에서 괄목할 만한 성과를 내며 사업에 가속도가 붙고 있다. SK㈜의 자회사가 개발한 뇌전증(간질) 치료제가 미국 식품의약국(FDA)으로부터 탁월한 약효를 인정받아 뇌전증 신약 중 세계 최초로 임상 3상 약효시험 없이 안전성 테스트만으로 신약 승인을 받을 수 있게 된 것이다. SK 측은 이에 따라 2018년에는 신약 시판이 가능할 것으로 보고 있으며, 미국 시장에서만 연 1조원 이상의 매출을 기대하고 있다.
 |
| 대전 대덕연구단지 내 SK바이오팜 연구소에서 연구원들이 독자 개발한 뇌전증 치료제 ‘YKP3089’와 관련한 연구를 하고 있다. SK 제공 |
SK바이오팜은 지난 4년간 미국·유럽·아시아에서 신약에 대한 임상 2상 전·후기 시험을 진행했다. 그 결과 기존 치료제보다 약효와 안정성이 뛰어난 것으로 확인돼 FDA로부터 추가적인 약효 임상을 생략해도 좋다는 공식 확인을 받았다고 SK바이오팜 측은 설명했다.
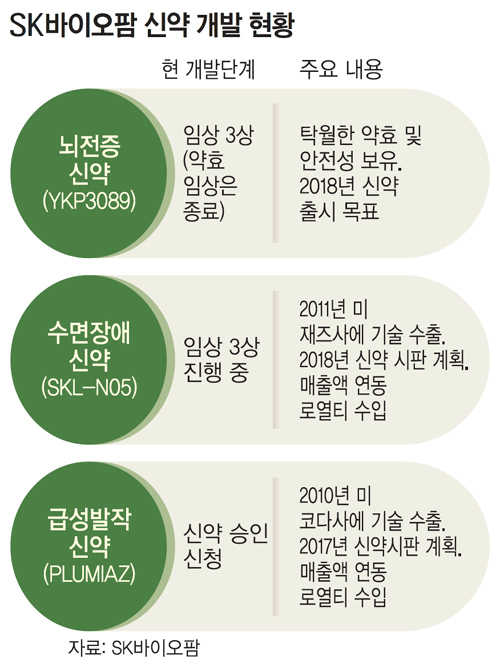
SK바이오팜 관계자는 “기존 약물로도 치료가 되지 않는 난치성 환자를 대상으로 임상 시험을 실시한 결과, 2상 후기 시험에서 발작빈도 감소율이 55%를 기록했다”면서 “기존 약물보다 2배 정도 약효가 뛰어난 것”이라고 밝혔다.
그룹 내부에서는 이번 신약 개발에 대해 쉽게 성과가 나기 어려운 제약 분야에 대한 최태원 회장의 뚝심 있는 투자가 결실로 나타난 것이라는 평가가 나온다.
SK그룹은 유공시절인 1993년 신약개발을 시작했으며, 2007년 지주회사 체제 전환 이후에는 신약개발 조직을 지주회사 직속으로 두고 그룹 차원에서 투자와 연구를 진행했다. 이후 SK㈜는 2011년 신약개발사업부를 물적 분할해 SK바이오팜을 설립했다.
SK바이오팜은 앞서 7개의 신약에 대해 FDA로부터 임상시험 신청 승인을 받았으며, 특히 2010년에는 급성발작 신약, 2011년에는 수면장애 신약으로 기술 수출에 성공했다. 이번에는 뇌전증 신약을 개발해 독자적인 임상시험까지 성공적으로 진행함으로써, 글로벌 제약회사로 발돋움할 계기를 마련한 것으로 평가된다.
SK바이오팜은 2018년에는 글로벌 시장에서 뇌전증 신약 시판을 시작할 수 있을 것으로 보고 있으며, 미국 시장에서만 연매출 1조원과 매출의 50%를 넘는 영업이익률을 낼 것으로 기대하고 있다.
제약산업 전문 시장조사 기관인 데이터모니터에 따르면 뇌전증 치료제 시장은 2014년 49억달러 규모에서 2018년에는 61억달러 규모로 연평균 6% 이상 지속적으로 성장할 것으로 예상된다.
SK바이오팜은 2020년까지 기업가치 10조원 규모의 글로벌 바이오·제약회사로 발전해 나간다는 목표다.
엄형준 기자 ting@segye.com
[ⓒ 세계일보 & Segye.com, 무단전재 및 재배포 금지]
![[설왕설래] 세계기록유산 등재된 제주 4·3](http://img.segye.com/content/image/2025/04/11/128/20250411512204.jpg
)
![[설왕설래] 충격적인 새만금 잼버리 감사 결과](http://img.segye.com/content/image/2025/04/10/128/20250410520749.jpg
)
![[기자가만난세상] 감정의 전쟁터에서](http://img.segye.com/content/image/2025/01/06/128/20250106520083.jpg
)
![[세계와우리] 강대국 틈에서 새 질서를 설계하라](http://img.segye.com/content/image/2024/02/15/128/20240215519554.jpg
)








